Foto por ALEXANDRE LALLEMAND en Unsplash
Las empresas de Latinoamérica, Asia, la CEI y Oriente Medio y Norte de África que deseen entrar en la UE deben obtener el certificado Pharma EU GMP para sus instalaciones de fabricación y completar el proceso de registro de medicamentos en la UE. Comprender el panorama normativo es esencial para sortear con éxito estos requisitos. Con más de 447 millones de pacientes, un crecimiento estable del mercado con precios elevados y buenos márgenes, el mercado europeo de medicamentos de venta libre y farmacéuticos es el lugar perfecto para ampliar sus ventas internacionales.
Potencial del mercado de la UE
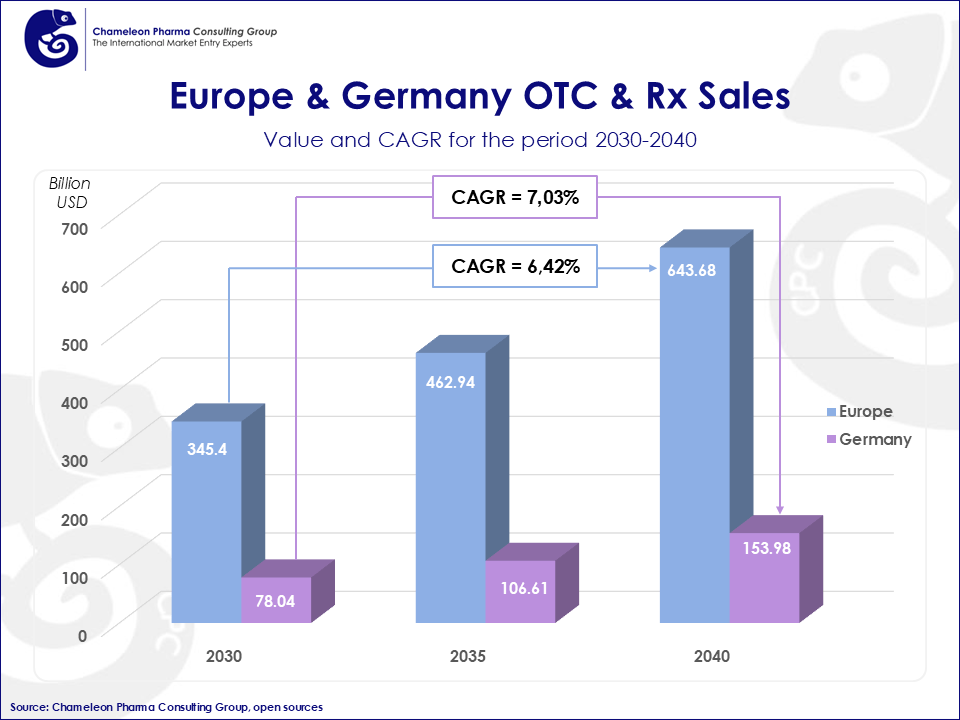
Figura 1: Proyección de las ventas de medicamentos sin receta y con receta en Europa y Alemania de 2030 a 2040
Se prevé que el mercado farmacéutico y de OTC de la UE crezca significativamente, con tasas de crecimiento anual constante del 6.42% para Europa y del 7.03% para Alemania entre 2030 y 2040. Se espera que las ventas de medicamentos de consumo y de prescripción en Europa superen los 640.000 millones de dólares en 2040. Además, el 85.5% de las ventas corresponde a medicamentos con receta, lo que pone de relieve la importancia de entrar en este mercado.

Figura 2: Cuota de mercado europea de las ventas de automedicación y Rx (2035F)
A diferencia de Asia, América Latina y Estados Unidos, donde los pacientes suelen tener que pagar por los medicamentos, en Europa las estancias hospitalarias, las intervenciones quirúrgicas y los fármacos utilizados durante el tratamiento son gratuitos. Este reembolso de los medicamentos recetados es una de las razones más poderosas para atraer a las empresas extranjeras.
Obtenga una ventaja competitiva: las ventajas de la certificación EU-GMP
La obtención del certificado Pharma EU-GMP le permite acceder por la vía rápida a más de 75 países de todo el mundo. Su fábrica y sus productos tendrán acceso no sólo al mercado europeo, sino también a otras regiones lucrativas como América Latina, la UE, Oriente Medio, Australia, EE.UU./Canadá y Asia, en las que se reconoce el certificado Pharma EU GMP sin inspecciones adicionales de GMP.
Ventajas de la certificación EU-GMP
- Cumplimiento normativo: Contar con BPF de la UE para su fábrica garantizará el cumplimiento de los estrictos requisitos de la UE, como la farmacovigilancia, el MDR (Reglamento de productos sanitarios) y las directrices de registro de medicamentos.
- Dependerá menos de su negocio en los mercados nacionales y podrá aumentar las ventas internacionales.
- Acceso al mercado: La certificación Pharma EU-GMP le permite registrar y vender sus productos en Europa, incluidos Alemania y el Reino Unido, que son mercados clave.
- Aumento de la reputación: La certificación Pharma EU-GMP mejora su credibilidad y reputación en todo el mundo, lo que facilita la obtención de asociaciones y contratos.
Pasos para obtener la certificación EU-GMP
El primer y más importante paso es la Auditoría Previa a la Certificación EU GMP y la Revisión del Expediente: realizar un análisis de brechas regulatorias (GAP analysis) para identificar obstáculos y garantizar el cumplimiento con los estándares de las Buenas Prácticas de Manufactura (GMP) farmacéuticas de la UE. CPC, como proveedor integral de servicios regulatorios, puede asistirle a usted y a su empresa a lo largo de todo este proceso. Si desea conocer más sobre cada uno de los pasos para obtener su certificación EU GMP farmacéutica, por favor contáctenos en service@chameleon-pharma.com para recibir la segunda parte de este artículo.
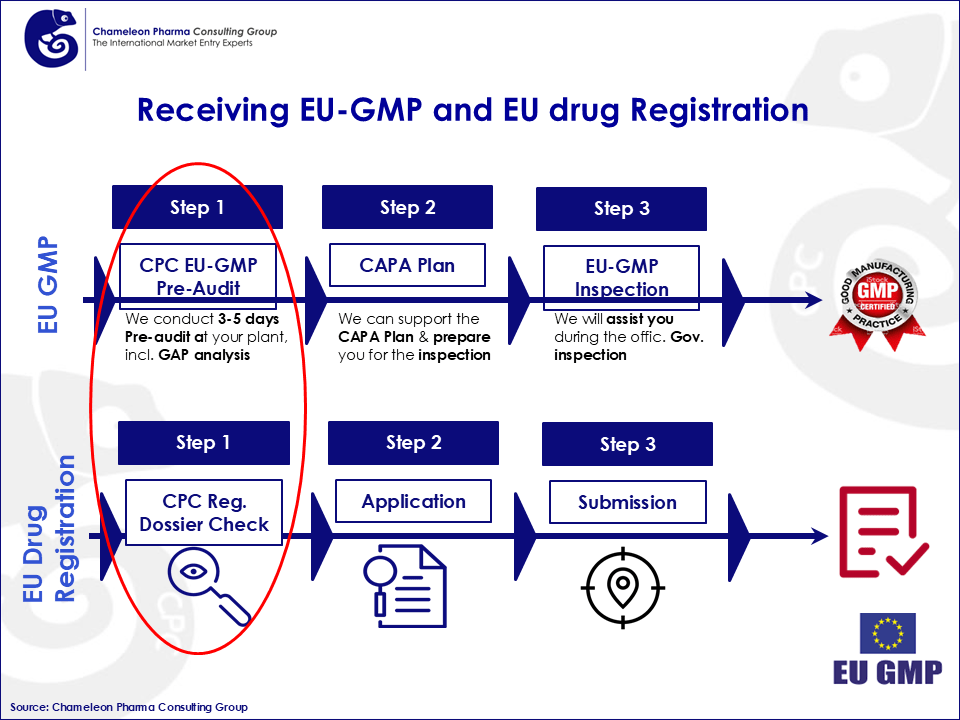
Figura 3: Recepción de EU-GMP y registro de medicamentos de la UE
Acelere su Entrada al Mercado con la Experiencia Regulatoria de CPC
En CPC, nos especializamos en guiar a las empresas a lo largo de este proceso. Nuestro enfoque sistemático incluye:
- Revisión de expedientes regulatorios para asegurar el cumplimiento con las directrices de registro de medicamentos de la UE.
- Preparación para inspecciones EU-GMP, aprovechando nuestra extensa red de inspectores.
- Tasa de éxito del 99 % en la obtención de la certificación EU-GMP farmacé
¿Por qué elegir a CPC?
- Experiencia: Contamos con un historial comprobado en América Latina y Asia, comprendiendo los desafíos únicos que enfrentan las empresas en estas regiones.
- Rapidez: Nuestro proceso optimizado garantiza una certificación ágil.
- Red de contactos: Nuestras conexiones con inspectores de la UE le otorgan una ventaja competitiva.
- Con nuestra Pre-Auditoría CPC, tiene el 90 % de la preparación para la EU-GMP completada.
El mercado de Consumer Health y medicamentos con receta (Rx) de la UE ofrece oportunidades sin igual para empresas de América Latina, Asia y MENA. Gracias a la experiencia de CPC, podrá navegar el complejo entorno regulatorio y desbloquear el potencial de este lucrativo mercado. Permítanos apoyarle para obtener la certificación EU-GMP farmacéutica y el registro de medicamentos en la UE, y llevar su negocio al siguiente nivel. Para conocer más detalles sobre cada paso del proceso, puede unirse a nuestro próximo seminario web con expertos: «Hoja de Ruta para Obtener la Certificación EU-GMP y el Registro de Medicamentos en la UE».
Chameleon Pharma Consulting Group (CPC) cuenta con más de 20 años de experiencia apoyando a empresas de los sectores farmacéutico, OTC, dispositivos médicos, fitoterapéuticos y medicina estética. Además, CPC ha establecido oficinas propias y centros locales en América Latina, Europa, Asia, EE.UU./Canadá, Oriente Medio y las regiones CEE/CIS, lo que representa otra gran ventaja. Gracias a esta red local y al conocimiento adquirido en más de 300 proyectos internacionales y un equipo de 25 expertos, ofrecemos a nuestros clientes:
- Desarrollo de Negocio, Fusiones y Adquisiciones (M&A) y Due Diligence
- Entrada y Expansión de Mercados: Análisis sistemático de productos y países, informes de mercado
- Asociaciones Estratégicas: Identificación de socios locales, adquisiciones o establecimiento de oficinas propias
- Regulación y Registro: Para medicamentos, dispositivos médicos, dermatología, medicina estética, etc.
- Autorización de Comercialización y Cumplimiento: Titularidad de registros, farmacovigilancia
- Calidad y Certificación: Certificación GMP, auditorías pre-GMP
Contáctenos hoy para una consulta personalizada en service@chameleon-pharma.com!




